PUBMED ОБЗОР: Исследование аппаратных методов борьбы с гипергидрозом
Гипергидроз – это неприятное хроническое вегетативное расстройство с частыми рецидивами. Потоотделение - нормальный физиологический процесс, необходимый для терморегуляции, выведения продуктов метаболизма и др. Однако его избыточность может привести к обострению многих заболеваний кожи, смущению из-за пятен на одежде или неприятного запаха, депрессии. Очень важно знать причины, механизмы возникновения и последствия гипергидроза, чтобы иметь возможность эффективно управлять им [3].
В прошлой статье мы подробно осветили причины появления заболевания, его диагностику и лечение привычными методами.
В данном обзоре, опираясь на иностранные научные источники, мы рассмотрим аппаратные техники лечения гипергидроза.
Микроволновая терапия
Микроволновая терапия (МВТ) — это нехирургический метод лечения гипергидроза, который был разработан для устранения недостатков традиционных методов лечения, таких как краткосрочная эффективность и плохая переносимость. IHHS (Международное общество гипергидроза) рекомендует терапию микроволнами в качестве варианта лечения второй линии у пациентов, которые не реагируют на другое местное лечение. [8].
Под микроволнами подразумевается электромагнитное излучение с частотой от 300 МГц до 300 ГГц. Этот частотный диапазон передает энергию в ткани через поглощаемое излучение, вызывающее диэлектрический нагрев. На молекулярном уровне он представляет собой быстро меняющееся электрическое поле, индуцированное микроволновым излучением; это поле воздействует на дипольные моменты в молекулах воды, присутствующие в ткани. Молекулы возбуждаются микроволновым полем, что приводит к нагреву тканей и возникновению разницы в диэлектрических свойствах между кожной и жировой тканью. На границе между ними генерируется большое количество отраженной энергии. Она возвращается обратно к излучателю, что создает оптимальную интерференционную картину с исходным излучением. Результатом является интерференция, то есть суммирование интенсивности электромагнитных волн в зоне перехода кожи (дермы) в ПЖК, и разрушающая интерференция вблизи эпидермального слоя (рис. 1). [23]
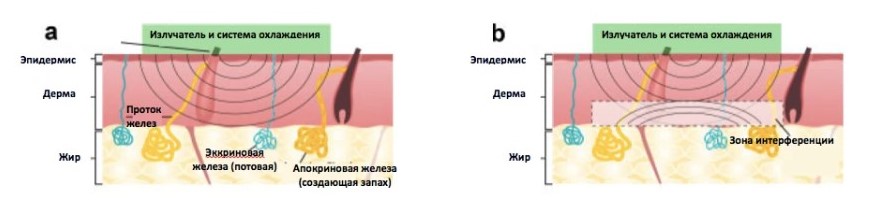
Рисунок 1. (a). Микроволны проходят через эпидермальный и дермальный слой.
(b). На границе кожи и ПЖК происходит значительное отражение излучения, что приводит к интерференции волн в дерме вблизи границы раздела.
(c). Система охлаждения защищает эпидермальный / верхний дермальный слой, но позволяет теплу проходить из области поглощения микроволн в целевую зону.
Микроволны относительно избирательны и предпочтительно нагревают ткани с высоким содержанием воды, например, железы, за счет большей диполярности молекул воды по сравнению с жиром. Это свойство оказалось полезным, позволив создать устройство, способное проникать в глубокие слои подкожной клетчатки с длиной волны 5,8 ГГц. На этом уровне (2 и 5мм), эккриновые и апокриновые железы могут быть разрушены путем термолиза. Гистология показывает, что затем они сменяются фиброзом. [19]
В настоящее время единственным устройством с микроволновой технологией, одобренным FDA, является miraDry, которое использует охлаждение и аспирацию для равномерного лечения и предотвращает повреждение окружающих тканей (например, нервных окончаний плечевого сплетения).
Проведение процедуры
Перед проведением процедуры проводится диагностика. Основным методом обычно выбирается оценка интенсивности потоотделения по 4-балльной шкале HDSS/
Вторичным способом диагностики - гравиметрическая оценка.
Для визуализации проблемной области используется крахмал-йодный тест, проба Минора.
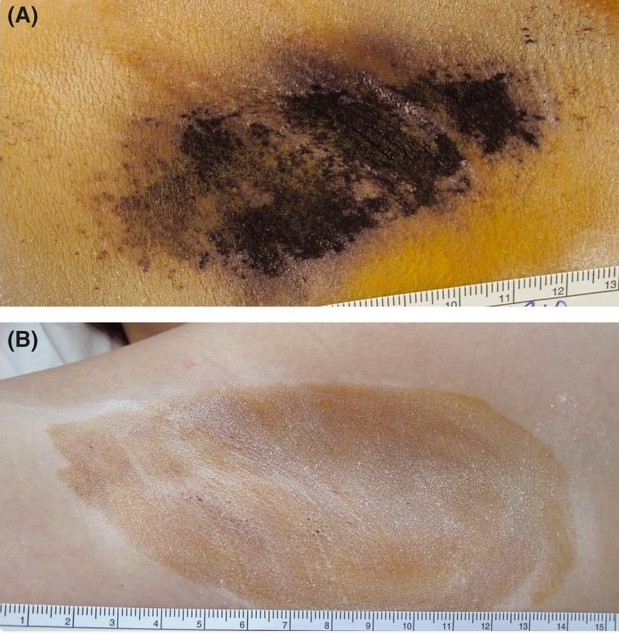
Рисунок 2. Крахмально-йодный тест на правой подмышечной впадины пациента при (А) исходном состоянии и (Б) при последующем визите через 6 месяцев после процедуры ВТ. Исходный показатель по шкале тяжести заболевания гипергидрозом (HDSS) у субъекта составлял 4. При визите через 6 месяцев балл HDSS составил 1, а потоотделение у субъекта снизилось на 91%, согласно гравиметрической оценке. Источник [9]
Процедура включает в себя три этапа:
1. На кожу помещается шаблон, размер которого соответствует поверхности подмышечного свода, чтобы обозначить ориентиры, показывающие, где на более позднем этапе будет размещен наконечник устройства.
2. На эту область наносится тумесцентная анестезия. В каждую подмышку вводят от 80 до 120 мл адреналина и 1% лидокаина (в физрастворе).
3. Проведение непосредственно самой процедуры, при которой кончик наконечника прикладывается для высвобождения микроволновой энергии в ранее отмеченных точках.
В зависимости от размера подмышек будет проведено от 12 до 39 аппликаций на каждую сторону, а время лечения может варьироваться от 25 до 40 минут соответственно.
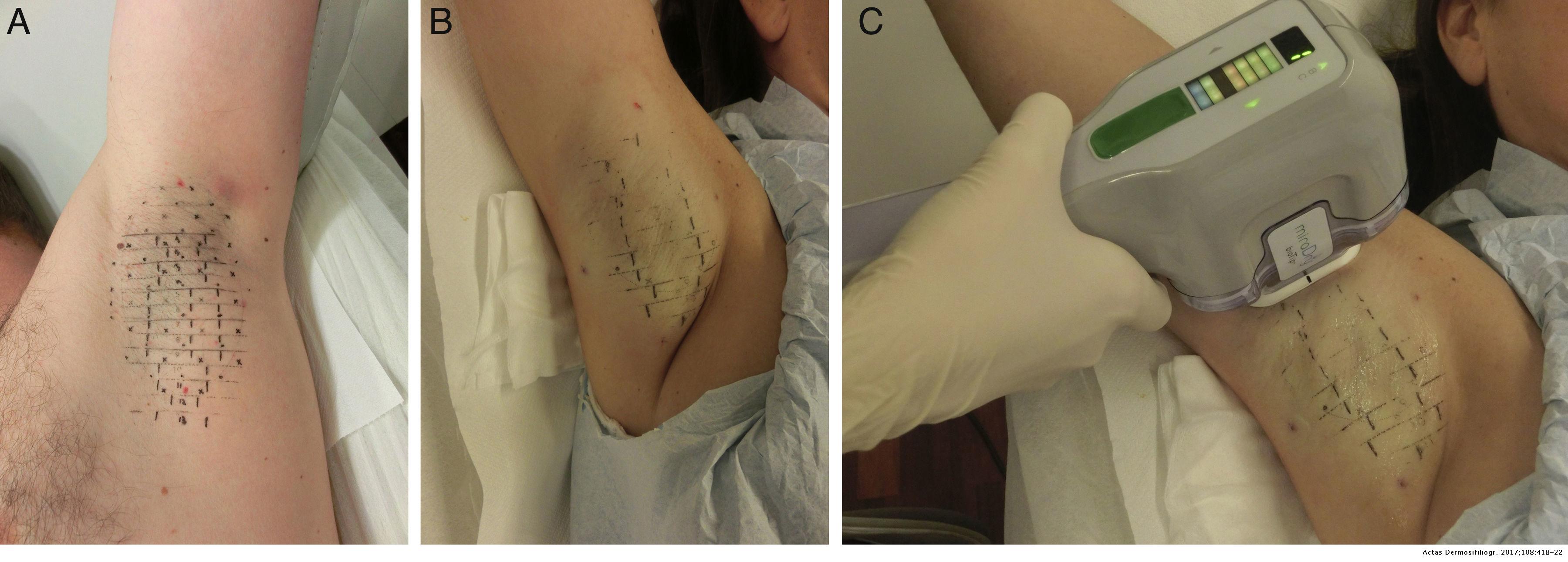
Рисунок 3. а. Метки шаблона, нанесенные перед обработкой. b. Применение тумесцентной анестезии. b. Применение микроволн с помощью портативного устройства. Источник[10]
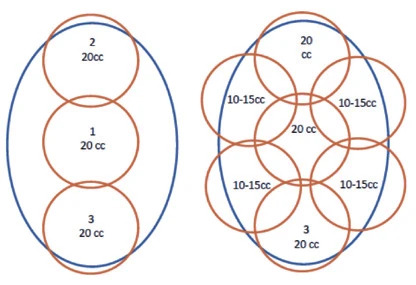
Рисунок 4. Дозировки анестезии в подмышечной области. Источник[23]
Эффект от процедуры длится всю жизнь, это связано с тем, что онтогенез потовых желез проходит только в эмбриональном периоде, так что они не регенерируют после рождения [23].
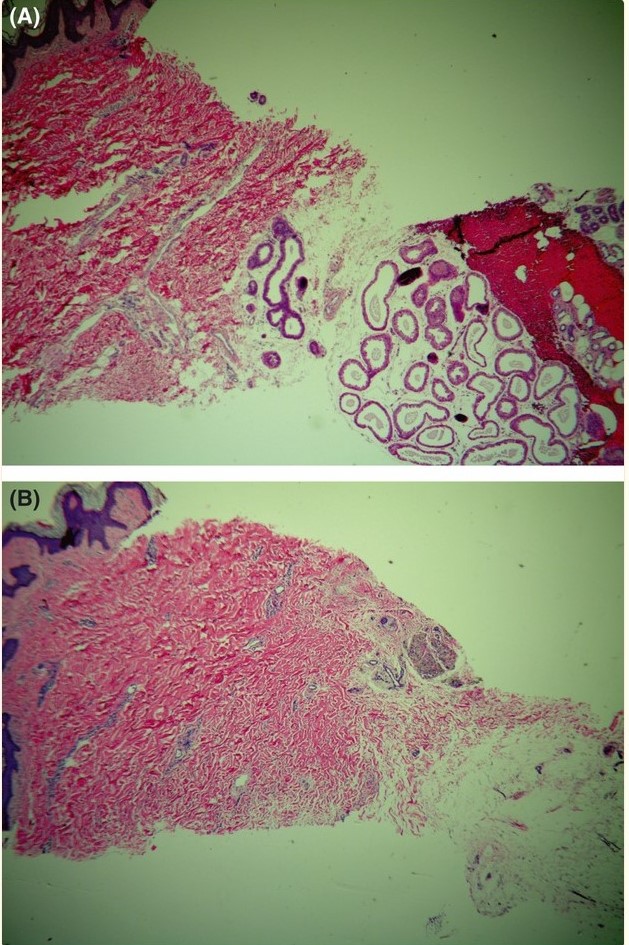
Рисунок 5. Гистологические образцы показывают (А) исходный вид потовых желез, расположенных прямо под кожей, и (Б) образец, взятый из другого места в той же подмышечной впадине после лечения. Образец после лечения показывает, что под кожей больше нет потовых желез. (Образец гематоксилин-эозина, увеличение ×40.)
Побочные эффекты
Почти у всех пациентов наблюдается болезненное местное воспаление и развиваются подкожные узелки, которые постепенно исчезают в течение первой недели. Также часто наблюдаются местные синяки, возникающие в результате травматизации тканей. Поэтому пероральные противовоспалительные препараты обычно назначаются в течение первых 72 часов вместе с применением холодного компресса. Дискомфорт может иногда длиться несколько недель, а иногда и 3–4 месяца, но не мешает повседневной деятельности.
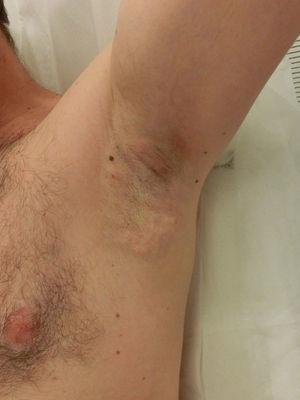
Рисунок 6. Местное воспаление и подкожные узелки после лечения.
Компенсаторный гипергидроз, по-видимому, является редким осложнением. Об этом сообщалось у 2 пациентов, у одного из которых после процедуры наблюдалось стойкое потоотделение лица [19].
В исследовании [9] сообщалось, что у большего количества пациентов наблюдались легкие нежелательные эффекты после процедуры, которые обычно длились от нескольких дней до недели; наиболее распространенными были отек (90% испытуемых), покраснение и следы вакуумирования (87% испытуемых) и дискомфорт (84% испытуемых). Долгосрочными эффектами (все они успешно разрешились) были изменение чувствительности кожи в подмышках (65% испытуемых, медиана продолжительности 37 дней, диапазон от 4 дней до 4 месяцев) и пальпируемые шишки под кожей в подмышках (71% испытуемых, медиана продолжительности составила 41 день, эффект наблюдался у двух субъектов на момент выхода из исследования). Продолжительность выпадения волос подмышками (о которой сообщили 26% участников) не рассчитывалась, поскольку у большинства пострадавших субъектов она продолжалась на момент выхода из исследования.
У 18 (58%) субъектов проявились эффекты, выходящие за пределы обрабатываемой области; 88% событий были оценены как легкие. Наиболее частым наблюдаемым эффектом (16 явлений у 12 субъектов) было изменение чувствительности кожи обработанной конечности (медиана продолжительности 50 дней, диапазон от 6 дней до 12 месяцев), и все они исчезли. Вторым по частоте эффектом был отек за пределами подмышечной впадины, в руке или груди (медиана продолжительности 7 дней, диапазон 2–23 дня). У одной пациентки после процедуры возникла преходящая невропатия левой руки с сопутствующей мышечной слабостью; через 6 месяцев после лечения наметилось улучшение, после чего она была исключена из наблюдения.
Случай, описанный в статье [6], призывает врачей быть осторожными при работе с пациентами, имеющими минимальное количество жира в области подмышек. С такими пациентами необходимо начинать МВТ с минимального уровня энергии. При несоблюдении данного правила можно получить повреждение плечевого сплетения с сенсорной и двигательной дисфункцией, как в данном случае [6]. Стоит отметить, что пациент за 6 месяцев реабилитации так и не смог полностью восстановиться.
В статье [21] сообщается о редком случае некроза подкожной клетчатки с разжижением жира, гематомы, возникшей после микроволнового лечения. Для восстановления пациенту потребовалось 3 недели.
Микроигольчатая радиочастотная терапия
Микроигольчатая радиочастотная терапия (RFM) является перспективным методом лечения гипергидроза. По механизму действия RFM совпадает с МВТ, т.е. разрушает эккриновые железы путем термолиза на границе глубокой дермы и подкожного слоя, сводя при этом к минимуму повреждение окружающих тканей.
Проведение процедуры
В исследовании [1] использовался аппарат INFINI (Lutronic, Goyang, Korea). Аппликатор INFINI состоит из 49 рядов изолированных микроигл площадью 10 мм, которые посылают радиочастотные импульсы с колебанием 1 МГц, проникающие под кожу.
Перед процедурой проводили крахмально-йодный тест. После определения области гипергидроза, для анестезии наносили эвтектическую смесь (2,5% лидокаина, соляной кислоты и 2,5% прилокаина) под окклюзионную повязку на 45 мин.
Затем кожу очистили спиртом и дали полностью высохнуть.
Лечение включало следующие параметры: (1) глубина 2–3 мм; (2) временной диапазон 120–180 мс, (3) уровень энергии 6–10, с люфтом ±10% от настроек энергии и времени, исходя из индивидуальных особенностей пацента.
С такими параметрами было совершено 3 прохода по обрабатываемой области.
По окончании процедуры обработанный участок накрывали вазелиновой марлевой повязкой.
Для местного заживления было рекомендовано применение оксида цинка несколько раз в день в течение нескольких дней после каждого сеанса лечения. Всем пациентам были проведены последующие процедуры через 3, 6 и 9 недель, и через 3 месяца.
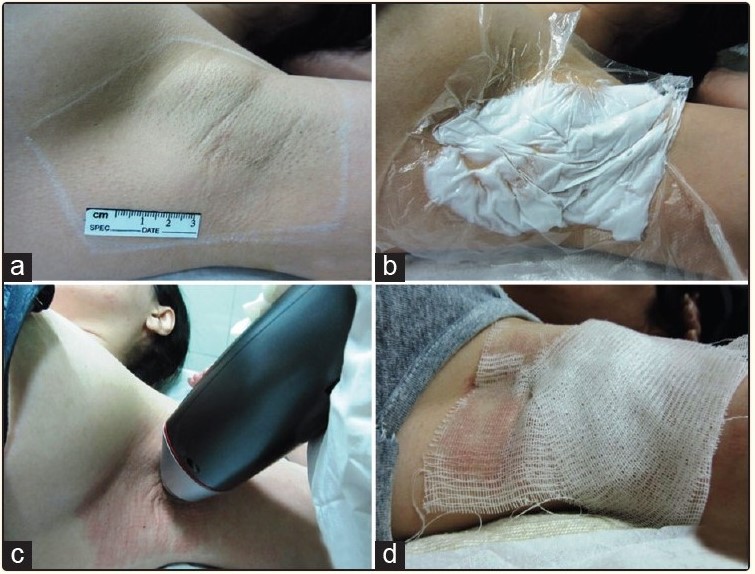
Рисунок 7. 4 этапа процедуры RFM. (a) Шаг 1 – определение размера обрабатываемой области и маркировка этой области после йод-крахмального теста. (б) Шаг 2 – Местная анестезия под окклюзией. (c) Шаг 3 – процедура RFM. (d) Шаг 4 – наложение стерильной вазелиновой марли. Источник [8]
Побочные эффекты
При лечении FMR не наблюдалось серьезных необратимых побочных эффектов. У большинства пациентов в пораженных участках наблюдались временные побочные эффекты (например, отек, боль и покраснение), которые обычно длились от нескольких дней до недели. Наиболее распространенными побочными эффектами были эритема (68% испытуемых) и точечные кровотечения (56% испытуемых).
У одного субъекта после процедуры возникло временное покалывание и онемение левой руки; прогноз консультирующего невролога был хорошим, и через 2 месяца после лечения у субъекта наступило спонтанное улучшение.
При длительном наблюдении не было зарегистрировано никаких серьезных постоянных побочных эффектов. [1]
Исследование [14] также подтверждает минимум побочных эффектов после FMR.
У 20 испытуемых побочные эффекты были минимальными и включали легкий дискомфорт, преходящий отек и поствоспалительную гиперпигментацию.
Эффективность
Эффективность FMR подтверждается исследованиями [12] и [14].
В исследовании [12] шестнадцать корейских пациентов с ладонным гипергидрозом прошли два сеанса лечения FMR с интервалом в 3 недели и находились под наблюдением до 15-й недели.
Результат:
Средний балл PSS значительно улучшился с 1,6 на 3-й неделе до 2,5 на 15-й неделе на 56%. Снижение потоотделения более чем на 50% по шкале PSS наблюдалось у 63% и 50% пациентов на 11 и 15 неделях соответственно. Средний балл HDSS значительно снизился к 3-й неделе и еще больше снизился к 7-й неделе. Средний балл GAIS улучшился после первого контрольного визита на 3-й неделе и снова улучшился на 7-й неделе. Средняя площадь гипергидроза, оцененная с помощью крахмально-йодного теста, значительно уменьшилась на 36 % на 15 неделе по сравнению с исходным уровнем. Средний уровень трансэпидермальной потери воды значительно снизился на 42% на 15 неделе по сравнению с исходным уровнем. Ни у одного пациента не наблюдалось каких-либо серьезных нежелательных явлений.
В исследовании [14] двадцать пациентов с ладонным гипергидрозом прошли 2 сеанса лечения FMR с 4-недельными интервалами. Клиническое улучшение оценивалось с использованием шкалы тяжести заболевания гипергидрозом (HDSS)
Результат:
Баллы HDSS значительно снизились с исходного уровня 3,3 до 1,5 и 1,8 после первого и второго месяцев наблюдения после лечения соответственно (p <0,001). По субъективной оценке через 1 месяц после второго курса лечения 75% пациентов (n = 15) имели балл по шкале HDSS 1 или 2, а 70% пациентов (n = 14) отметили улучшение состояния более чем на 50%. Крахмально-йодная реакция также значительно снизилась у 95% пациентов (n = 19) после лечения FMR. Гистологические данные показали уменьшение количества и размеров как апокриновых, так и эккриновых желез через 1 месяц после окончательного лечения.
HDSS – шкала тяжести Hyperhidrosis Disease Severity Scale
PSS (Patient Satisfaction Scale) – шкала удовлетворенности пациентов
GAIS (Global Aesthetic Improvement Scale) – шкала общего эстетического улучшения
!Интересно! В 2022 году в Таиланде было проведено сравнительное исследование лечения гипергидроза FMR и введением БТА[18].
В исследование были включены двадцать женщин, у которых клинически диагностирован первичный аксиллярный гипергидроз. Все субъекты были рандомизированы для получения либо процедуры FMR на подмышечной впадине с одной стороны, либо 50 ед. ботулотоксина А на контралатеральной подмышечной впадине.
При сравнении двух групп при конечном визите (12-я неделя) в группе, получавшей ботулотоксин А, наблюдалось значительно большее снижение среднего показателя HDSS, чем в группе, получавшей FMR: 1,60 (0,59) против 2,05 (0,68) соответственно (p = 0,0332). Также группа, получавшая ботулотоксин А, имела значительно больший показатель удовлетворенности по квартильной шкале, чем группа, получавшая FMR (2,55 + 0,69 против 1,70 + 1,03 соответственно, p = 0,004). Таким образом, в исследовании [18] использование БТА показало большую эффективность, чем FMR при лечении первичного подмышечного гипергидроза.
Лазерная терапия
Лазеры в терапии гипергидрозов используются в 3 направлениях.
Первое направление – трансдермальная доставка ботулотоксина.
Так, например, в исследовании [13] 3 пациентам в течение 2 сеансов с 2-х недельным перерывом обрабатывали ладони фракционным лазером CO2, после чего местно применяли раствор с 50ед. БТА.
Выработку пота оценивали на основании размера области потоотделения (измеренной с помощью минорного йод-крахмального теста) и субъективной оценки выработки пота с использованием визуальной аналоговой шкалы (ВАШ). Итого, снижение средней выработки пота составило 51,6% через 2 недели после первой обработки и 88,5%, 67,8% и 52,9% через 1, 2 и 3 месяца соответственно после последней обработки. Ни у одного пациента не наблюдалось побочных эффектов.
А в результате исследования [2], ученые пришли к выводу, что интенсивность боли при использовании фракционного лазера CO2 при терапии ладонного гипергидроза гораздо меньше, чем при инъекционном введении БТА.
Второе направление – подкожная коагуляция потовых желез лазером Nd:YAG
Подробно данная процедура описана в исследовании [17].
Было подобрано 24 пациента (9 женщин и 15 мужчин, 48 подмышек) в возрасте 19-57 (средний возраст 35,4) лет, с ИМТ 26,05 ± 2,05 кг/м2 и подмышечным бромгидрозом для лечения лазером с 1444 -нм Nd:YAG (LipoAi; DEKA, Флоренция, Италия)
Все процедуры проводились амбулаторно под местной анестезией. Чтобы лучше определить область роста волос, всех участников проинструктировали не брить обе подмышки за 1 неделю до процедуры. После обычной тумесцентной анестезии, при которой в каждую подмышку вводился анестетик, состоящий из 0,4% раствора лидокаина, на переднем и дистальном краях каждой подмышки делались два/четыре небольших отверстия (в зависимости от размера обрабатываемой зоны) иглой 18 G.
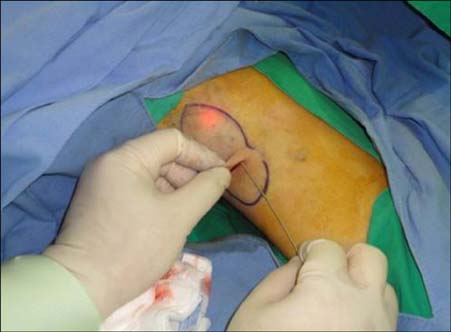
Рисунок 8. Во время лазерной коагуляции. Источник: [15].
На всем протяжении разреза канюлю вводили в целевой слой ПЖК. Лазер применялся крест-накрест с повторной канюляцией. Внутри канюли проведено оптическое волокно 600 мкм. Настройка лазера была следующей: энергия импульса = 175 мДж, частота импульсов = 40 Гц (мощность 7 Вт). Энергия варьировалась от 1800 до 2300 Дж (средняя энергия 2092 Дж). Облучали лазером один раз область в 0,5−1,0 см 2 в течение 1,5 с. Холодные компрессы накладывались сразу после лазерной обработки на обработанные области, чтобы снизить риск термического повреждения кожи. Швы на разрещы не накладывались. Процедура заняла около 5 минут для каждой стороны. После лазерной обработки на 24 часа накладывалась компрессионная повязка.
В общей сложности 24 пациента находились под наблюдением в течение 6 месяцев после лазерного лечения. Исходно все пациенты (100%) жаловались на сильный неприятный запах из подмышек. При наблюдении на 30 день после процедуры уровень неприятного запаха оценивался как отсутствующий у 14 пациентов (58%), удовлетворительный у восьми пациентов (33%) и сильный у двух пациентов (8%). При наблюдении через полгода уровень неприятного запаха оценивался как отсутствующий у 14 пациентов (58%), удовлетворительный у девяти пациентов (37%) и сильный у одного пациента (9%)
Удовлетворенность субъекта оценивалась по трехбалльной шкале: 0 = плохо, 1 = удовлетворительно и 2 = хорошо. Через месяц после лазерного лечения 19 пациентов (79%) сообщили о хорошей удовлетворенности, четыре пациента (17%) сообщили об удовлетворительном состоянии и только один пациент (4%) сообщил о неудовлетворенности. Через 6 месяцев 17 пациентов (71%) сообщили о хорошей удовлетворенности, шесть пациентов (25%) сообщили об удовлетворительном состоянии и один пациент (4%) сообщил о неудовлетворенности.
Побочные эффекты в исследовании [17]
По сравнению со стандартной операцией побочные эффекты были легкими. У двадцати восьми из 48 пролеченных подмышек (58%) наблюдались экхимозы, которые обычно проходили в течение 1 или 2 недель. Только один пациент (4,2%) сообщил о неглубоком ожоге второй степени только в одной подмышечной впадине (2,1% обработанных подмышек). Ожог полностью зажил в течение 10 недель без образования рубцов и контрактур. Больной находился под наблюдением до полного выздоровления.
Авторы не отметили никаких осложнений, таких как гранулема, серома, расхождение краев или раневая инфекция. В течение клинического периода наблюдения некрозов кожи не было.
Успешное проведение лазерной коагуляции потовых желез подтверждают и другие исследования.
Например, в исследовании [15] процедура была проведена 3 пациентам с подмышечным осмидрозом
Осмидроз (бромидроз, бромгидроз) - пот с неприятным запахом, обусловленным зловонными веществами, образующимися при разложении пота под воздействием бактерий (обычно стафилококков)
По результатам исследования, у всех трех пациентов не было выявлено рецидива подмышечного осмидроза, и они были удовлетворены результатами лечения. У двух пациентов развился экхимоз, который разрешился в течение нескольких дней. Серьезных осложнений, включая гематомы, гранулемы и послеоперационную инфекцию, не наблюдалось.
В исследовании [11], восемнадцать пациентов (семь мужчин и 11 женщин, 36 подмышечных впадин) с подмышечным бромгидрозом (у пяти пациентов также был гипергидроз) в возрасте от 18 до 52 лет (в среднем 33,2 года; диапазон 18–52 года) получали лечение Nd: YAG с длиной волны 1444 нм (Accusculpt; Lutronic Corp., Коян, Корея).
Через 1 месяц после процедуры устранение неприятного запаха было значительным в 22 подмышках (61%), удовлетворительным в 12 подмышках (33%) и слабым в двух подмышках (6%). Через 6 месяцев устранение неприятного запаха было значительным в 20 подмышках (56%), удовлетворительным в 12 подмышках (33%) и слабым в четырех подмышках (11%). После лазерного лечения в течение 1 месяца удовлетворенность пациентов была значительной у 15 пациентов (83%), частичная удовлетворенность наблюдалась у трех пациентов (17%). Через 6 месяцев удовлетворенность пациентов была значительной у 14 пациентов (78%), частичная удовлетворенность наблюдалась у трех пациентов (17%), один пациент жалел о проведенной процедуре (5%).
Побочные эффекты были легкими по сравнению. Из 36 пролеченных подмышек у 20 (56%) наблюдались экхимозы, которые обычно проходили в течение нескольких недель. Кроме того, поверхностный некроз эпидермиса был обнаружен в четырех подмышках (11%) (которые зажили с помощью консервативного лечения), гипертрофические рубцы в двух подмышках (которые были почти сглажены при внутриочаговой инъекции 8 мг/мл 6% триамцинолона) и временная пигментация кожи в шести подмышечных впадинах (которая почти спонтанно исчезла в течение 1 года; 17%). Ученые не наблюдали каких-либо осложнений, таких как гематома, серома, гранулема, раневая инфекция или расхождение краев. Гистопатологическое исследование выявило снижение плотности и значительные изменения апокринных желез после лечения.
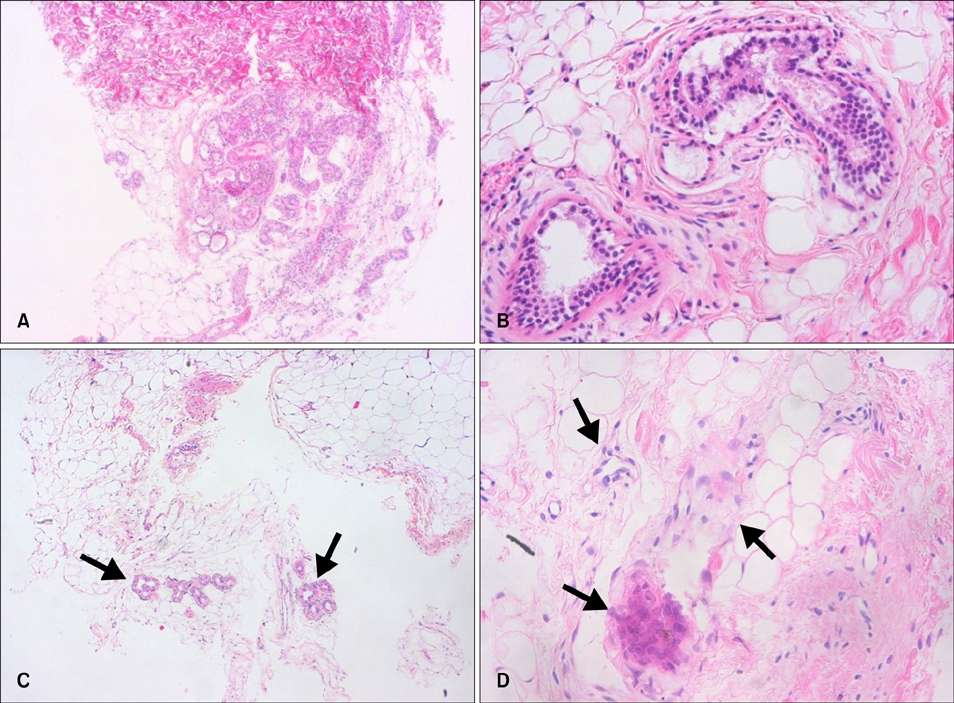
Рисунок 9. До- и послеоперационные гистологические данные. (A, B) Гистологическая картина до операции (H&E, A: ×40 и B: ×200). (C) Гистологическая картина через 6 месяцев наблюдения. Очевидно снижение плотности апокриновых желез (стрелки) (H&E, ×40). (D) Гистологическая картина через 6 месяцев наблюдения. Присутствуют дистрофические апокриновые железы (стрелки) (H&E, ×200).
При лазерной коагуляции импульсная длина волны Nd:YAG может быть разной. К сожалению, способность волн длиной 1064 нм к растворению жира довольно низка, поэтому растопить жир на большой площади сложно и затратно по времени.
Кроме того, исследователи обнаружили, что длина волны 1444 нм обеспечивает наивысшую степень эффективности селективной абляции жировой ткани и термического ограничения, позволяя за короткое время удалить жир в различных областях. По сравнению с другими длинами волн - длина 1444 нм поглощается жиром сильнее, чем водой.
Было показано, что эта длина волны оказывает больший липолитический эффект по сравнению с длинами волн 1064 нм и 1320 нм, что означает более высокую эффективность вместе с удержанием тепла с ограниченной диффузией в окружающие ткани.
Другими словами, лазерам с длиной волны 1064 и 1320 нм требуется большее количество энергии, в три или два раза соответственно, чем лазеру с длиной волны 1444 нм для обработки того же объема. В том же исследовании также было обнаружено, что, поскольку основной мишенью является жир, селективный фототермолиз происходит при длине волны 1444 нм, поскольку эта длина волны соответствует пику поглощения жира.
Третье направление – лечение гипергидроза в режиме лазерной эпиляции
Данное направление сейчас находится в активной исследовательской фазе. Пока нет однозначных результатов, показывающих эффективность метода. Исследования говорят о совершенно разных результатах.
В исследовании [16] Letada et al одну подмышку у шести разных пациентов с подмышечным гипергидрозом лечили ежемесячными сеансами лазерной эпиляции с использованием Nd:YAG-лазера с длиной волны 1064 нм при типичных настройках. Контралатеральная подмышка выступала в качестве контроля. Субъектов просили субъективно классифицировать улучшение подмышечной потливости с помощью опросника глобальной оценки (GAQ) еженедельно после каждого лечения. Качественную оценку потоотделения также проводили с использованием модифицированного йод-крахмального теста ежемесячно после каждого лечения. Кроме того, до первого лечения и через месяц после последнего лечения была проведена пункционная биопсия подмышечной впадины для оценки гистологических изменений в эккринной железе и окружающих структурах.
В результате наблюдались статистически значимые улучшения субъективных оценок потоотделения с использованием GAQ по сравнению с исходным уровнем. Объективные улучшения потоотделения при тестировании модифицированного крахмала и йода по сравнению с обработанными и необработанными подмышками также наблюдались в течение как минимум девяти месяцев у выбранных субъектов. При рутинном гистологическом исследовании не было отмечено существенных различий в биопсиях до и после лечения.
В рандомизированном контролируемом сравнительном исследовании. [5] двадцать один пациент прошел лечение 5 циклами диодного лазера с длиной волны 800 нм. Скорость потоотделения документировали с помощью гравиметрии и визуальной аналоговой шкалы. Гистологическое исследование проводилось всем пациентам до и после лечения.
В результате было отмечено значительное снижение скорости потоотделения наблюдалось у пациентов, обработанных лазером (медиана 89 мг/мин, диапазон 42–208 мг/мин против 48 мг/мин, диапазон 17–119 мг/мин; p < 0,001) и необработанные контралатеральные (медиана 78 мг/мин, диапазон 25-220 мг/мин против медианы 65 мг/мин, диапазон 24-399 мг/мин; p = 0,04) стороны, хотя значимой разницы между обработанными и необработанными сторонами обнаружено не было. (р = 0,10).
В конце исследования авторы делают выводы, что, не смотря на значительное снижение потоотделения на обработанных лазером участках, лазерная эпиляция не смогла снизить потоотделение значительно больше, чем на необработанной контралатеральной стороне. Эти результаты, вероятно, указывают на эффект плацебо, а не на прямой терапевтический эффект лазерной эпиляции.
В исследовании [4] потоотделение обеих подмышек оценивали объективно с помощью йодо-крахмального теста для планиметрического измерения и субъективно с помощью визуальной аналоговой шкалы (ВАШ) до лечения, а также через 1 месяц и 1 год после последнего сеанса.
Результаты этого исследования определяют, что обработка подмышечных волос с помощью Nd:YAG-лазера с длиной волны 1064 нм может вызвать гипергидроз, и этот эффект не является временным.
Фотодинамическая терапия
Фотодинамическая терапия (ФДТ) с использованием эозина в качестве фотосенсибилизатора разрабатывается как перспективный метод лечения ладонного и подмышечного гипергидроза.
В исследовании [7] шестерых пациентов лечили от ладонного гипергидроза с помощью ФДТ, используя в качестве фотосенсибилизатора гель на основе трансферсомального эозина желтого Y (EY).
Трансферсомы - везикулы, состоящие из фосфатидилхолина, сурфактанта и этанола, обладают повышенной проникающей способностью через межклеточные поры, что достигается путем добавления мембранных модификаторов - холата натрия, стеариламина, Span 60, Span 80, Tween 60 и Tween 80 -поверхностно-активных веществ, способствующих дестабилизации липидных бислоев и увеличению деформируемости липосомных мембран [22]
Трансферсомы были получены следующим образом:
Липид (лецитин из соевого масла) и мембранный модификатор (дезоксихолат натрия) растворяли в смеси хлороформ: метанол 2:1. Органические растворители затем выпаривали в вакууме на ротационном испарителе, вращающемся со скоростью 90 об/мин при 45°C. Вращение продолжают до полного испарения растворителей и образования однородной тонкой липидной пленки. Полученную липидную пленку затем гидратировали фосфатно-буферным раствором EY и оставляли в ротационном испарителе еще на 1 час. Соотношение липид: мембранный модификатор:EY было установлено как 10:1:1. Дисперсию трансферсом обрабатывали ультразвуком в течение 5 мин на водяной бане и хранили в холодильнике для дальнейшего использования.
Приготовление трансферсомального эозинового гидрогеля
Подготовленные трансферсомы, нагруженные EY, были включены в 5% гидрогель Na-CMC. Объем трансферсомальной суспензии, соответствующий 20 мг EY, доводили до 100 мл дистиллированной водой. Затем порциями добавляли 5 г Na-CMC при постоянном перемешивании до полного диспергирования. Затем при непрерывном перемешивании добавляли метилпарабен (0,1%) и пропилпарабен (0,2%) в качестве консервантов. Гель оставляли на 24 ч для полного набухания.
Протокол лечения
Ладони были подвергнуты 2 проходам фракционного CO 2 -лазера со следующими параметрами: область сканирования 3~20 мм, Y: 3~20 мм, плотность энергии 7,5 мДж/см 2 , длительность импульса 500 мкс и плотность точек 0,8. После этого на 5 мин наносили трансферсомальный гель EY.
Затем обработанные участки облучались интенсивным импульсным светом (IPL, EPI-C PLUS; Espansione Group, Болонья, Италия) в качестве источника света для активации фотосенсибилизатора, оснащенного фильтром 550 нм, который соответствует максимальному пику поглощения EY. (площадь пятна 2,5 × 4,5 см, общая площадь 11,25 см 2 , длительность импульса 20 мс, плотность энергии 25 Дж/см 2 ).
Сеансы проводились один раз в неделю в течение 6 недель. Оценка проводилась с помощью крахмально-йодного теста для определения площади гипергидроза до и после лечения.
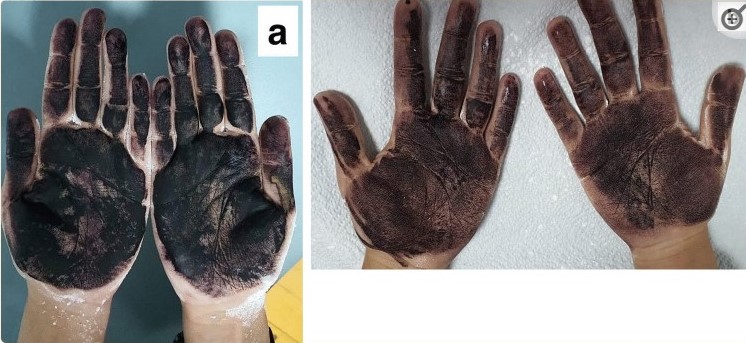
Рисунок 10. Проба минора до и после лечения
Результаты
Результаты исследования показали, что два пациента достигли 90% улучшения после четырех сеансов, трем пациентам потребовалось шесть сеансов, чтобы показать улучшение на 75%, а один пациент показал улучшение только на 25% после шести сеансов.
Боль, которую испытывали пациенты во время сеансов лечения, была терпимой, и местные анестетики не требовались
В качестве фотосенсибилизатора для ФДТ можно использовать также метиленовый синий.
Это подтверждает исследование [20], в котором для ФДТ были протестированы два фотосенсибилизатора: эозин Y и метиленовый синий для правой и левой руки соответственно. Результаты подтвердили эффективное снижение степени тяжести гипергидроза со сравнимыми результатами при использовании обоих фотосенсибилизаторов.
Источники:
1. Abtahi-Naeini B, Naeini FF, Saffaei A, et al. Treatment of Primary Axillary Hyperhidrosis by Fractional Microneedle Radiofrequency: Is it Still Effective after Long-term Follow-up? Indian Journal of Dermatology. 2016 Mar-Apr;61(2):234. DOI: 10.4103/0019-5154.177789. PMID: 27057039; PMCID: PMC4817464.
2. Agamia NF, Sobhy N, Abd-Elraouf A, Tawfik A. Fractional CO2 Laser for Transcutaneous Drug Delivery of Onabotulinum Toxin in Palmar Hyperhidrosis. Dermatol Surg. 2021 May 1;47(5):678-683. doi: 10.1097/DSS.0000000000002901. PMID: 33337732.
3. Arora, G, Kassir, M, Patil, A, et al. Treatment of Axillary hyperhidrosis. J Cosmet Dermatol. 2022; 21: 62–70. https://doi.org/10.1111/jocd.14378
4. Aydin F, Pancar GS, Senturk N, Bek Y, Yuksel EP, Canturk T, Turanli AY. Axillary hair removal with 1064-nm Nd:YAG laser increases sweat production. Clin Exp Dermatol. 2010 Aug;35(6):588-92. doi: 10.1111/j.1365-2230.2009.03638.x. Epub 2009 Oct 23. PMID: 19874331.
5. Bechara FG, Georgas D, Sand M, Stücker M, Othlinghaus N, Altmeyer P, Gambichler T. Effects of a long-pulsed 800-nm diode laser on axillary hyperhidrosis: a randomized controlled half-side comparison study. Dermatol Surg. 2012 May;38(5):736-40. doi: 10.1111/j.1524-4725.2012.02339.x. Epub 2012 Jan 24. PMID: 22273498.
6. Chang CK, Chen CY, Hsu KF, Chiu HT, Chu TS, Liu HH, Goh MX, Chen SG. Brachial plexus injury after microwave-based treatment for axillary hyperhidrosis and osmidrosis. J Cosmet Laser Ther. 2017 Nov;19(7):439-441. doi: 10.1080/14764172.2017.1342039. Epub 2017 Jun 28. PMID: 28657370.
7. Fadeel DAA, Fadel M, Tawfik A, Omar Y. Transfersomal eosin topical delivery assisted by fractional CO2 laser for photodynamic treatment of palmar hyperhidrosis: case study. Drug Deliv Transl Res. 2022 Dec;12(12):3000-3006. doi: 10.1007/s13346-022-01164-z. Epub 2022 Apr 20. PMID: 35441986; PMCID: PMC9636100.
8. Fatemi Naeini F, Pourazizi M, Abtahi-Naeini B, Nilforoushzadeh MA, Najafian J. A novel option for treatment of primary axillary hyperhidrosis: fractionated microneedle radiofrequency. J Postgrad Med. 2015 Apr-Jun;61(2):141-3. doi: 10.4103/0022-3859.153111. PMID: 25766356; PMCID: PMC4943439.
9. Hong HC, Lupin M, O'Shaughnessy KF. Clinical evaluation of a microwave device for treating axillary hyperhidrosis. Dermatol Surg. 2012 May;38(5):728-35. doi: 10.1111/j.1524-4725.2012.02375.x. Epub 2012 Mar 27. PMID: 22452511; PMCID: PMC3489040.
10. Jacob CI. Examining hyperhidrosis: an update on new treatments. Am J Manag Care. 2018 Dec;24(23 Suppl):S496-S501. PMID: 30589249.
11. Jung SK, Jang HW, Kim HJ, Lee SG, Lee KG, Kim SY, Yi SM, Kim JH, Kim IH. A Prospective, Long-Term Follow-Up Study of 1,444 nm Nd:YAG Laser: A New Modality for Treating Axillary Bromhidrosis. Ann Dermatol. 2014 Apr;26(2):184-8. doi: 10.5021/ad.2014.26.2.184. Epub 2014 Apr 30. PMID: 24882972; PMCID: PMC4037670.
12. Jung JM, Na HM, Kim JH, Yoon J, Yang HJ, Lee WJ, Chang SE, Lee MW, Won CH. The efficacy and safety of a fractional microneedle radiofrequency device for the treatment of axillary hyperhidrosis: clinical prospective pilot study. Lasers Med Sci. 2022 Apr;37(3):1559-1566. doi: 10.1007/s10103-021-03404-z. Epub 2021 Aug 28. PMID: 34453655.
13. Junsuwan N, Manuskiatti W, Phothong W, Wanitphakdeedecha R. Fractional CO2 laser-assisted Botulinum toxin type A delivery for the treatment of primary palmar hyperhidrosis. Lasers Med Sci. 2021 Feb;36(1):233-236. doi: 10.1007/s10103-020-03064-5. Epub 2020 Jun 17. PMID: 32557001.
14. Kim M, Shin JY, Lee J, Kim JY, Oh SH. Efficacy of fractional microneedle radiofrequency device in the treatment of primary axillary hyperhidrosis: a pilot study. Dermatology. 2013;227(3):243-9. doi: 10.1159/000354602. Epub 2013 Oct 4. PMID: 24107595.
15. Lee SG, Ryu HJ, Kim IH. Minimally Invasive Surgery for Axillary Osmidrosis Using a Combination of Subcutaneous Tissue Removal and a 1,444-nm Nd:YAG Laser. Ann Dermatol. 2014 Dec;26(6):755-7. doi: 10.5021/ad.2014.26.6.755. Epub 2014 Nov 26. PMID: 25473231; PMCID: PMC4252676.
16. Letada PR, Landers JT, Uebelhoer NS, Shumaker PR. Treatment of focal axillary hyperhidrosis using a long-pulsed Nd:YAG 1064 nm laser at hair reduction settings. J Drugs Dermatol. 2012 Jan;11(1):59-63. PMID: 22206078.
17. Piccolo D, Mutlag MH, Pieri L, Fusco I, Conforti C, Crisman G, Bonan P. Minimally invasive 1,444-nm Nd:YAG laser treatment for axillary bromhidrosis. Front Med (Lausanne). 2023 Feb 6;10:1034122. doi: 10.3389/fmed.2023.1034122. PMID: 36814776; PMCID: PMC9939433.
18. Rummaneethorn P, Chalermchai T. A comparative study between intradermal botulinum toxin A and fractional microneedle radiofrequency (FMR) for the treatment of primary axillary hyperhidrosis. Lasers Med Sci. 2020 Jul;35(5):1179-1184. doi: 10.1007/s10103-020-02958-8. Epub 2020 Jan 14. PMID: 31939036.
19. Sánchez-Carpintero I, Martín-Gorgojo A, Ruiz-Rodríguez R. Tratamiento con microondas en la hiperhidrosis y bromhidrosis axilar. Actas Dermosifiliogr. 2017;108:418–422
20. Shabaik AHA, Shaheen MA, Soltan MY. Efficacy of photodynamic therapy for treatment of primary palmar hyperhidrosis. Dermatol Ther. 2021 Jan;34(1):e14659. doi: 10.1111/dth.14659. Epub 2020 Dec 16. PMID: 33301218.
21. Zhang B, Huang L. Subcutaneous tissue necrosis with fat liquefaction, hematoma, inflammatory mass after microwave-based treatment for axillary hyperhidrosis. J Cosmet Dermatol. 2022 Oct;21(10):4365-4369. doi: 10.1111/jocd.14820. Epub 2022 Apr 24. PMID: 35100491.
22. Соколов А.В., Костин Н.Н., Овчинникова Л.А., Ломакин Я.А., Кудряева А.А. Направленный транспорт лекарственных препаратов в липидоподобных наноконтейнерах и внеклеточных везикулах // Acta Naturae (русскоязычная версия). 2019. №2 (41). URL: https://cyberleninka.ru/article/n/napravlennyy-transport-lekarstvennyh-preparatov-v-lipidopodobnyh-nanokonteynerah-i-vnekletochnyh-vezikulah
23. Чеботарева Ю. Ю. Микроволны против гипергидроза//https://www.1nep.ru/articles/lechenie-gipergidroza-na-apparate-miradry/?ysclid=lmujf4a5ts937085617
прочитано
7176
раз